Redox Biology | 国家重点研发计划首席科学家教授团队深度解析色氨酸代谢物3-HAA—治疗BPD的 “秘密武器”
英文标题:The tryptophan metabolite 3-hydroxyanthranilic acid alleviates hyperoxia-induced bronchopulmonary dysplasia via inhibiting ferroptosis
中文标题:色氨酸代谢产物3-羟基邻氨基苯甲酸(3-HAA)通过抑制铁死亡缓解高氧诱导的支气管肺发育不良
发表期刊:Redox Biology
影响因子:10.7
客户单位:重庆医科大学附属儿童医院
百趣提供服务:色氨酸高通量靶标代谢组学、MetPro-Ⅱ代谢物与蛋白相互作用
研究背景
支气管肺发育不良(Bronchopulmonary Dysplasia, BPD)是一种常见于早产儿的慢性呼吸系统疾病。随着极早产儿存活率的提升,支气管肺发育不良的发病率却居高不下,这严重影响了早产儿的生存率和生活质量。探索BPD的潜在机制有助于开发新的有效治疗策略。
有研究表明,色氨酸代谢物吲哚-3-乙酸在慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Disease, COPD)中具有调节炎症、改善肺气肿和缓解肺功能下降的潜在作用。由于COPD与BPD有一些共同的病理特征,而色氨酸代谢在病理条件下会受到影响,所以色氨酸及其代谢物是非常有吸引力的诊断、预后和治疗生物标志物。此外,色氨酸代谢物的生物学效应及其在疾病中的变化表明,它们可能作为潜在的治疗靶点。但目前,色氨酸代谢产物在新生儿BPD中的复杂功能和机制仍有待探索。
研究概览
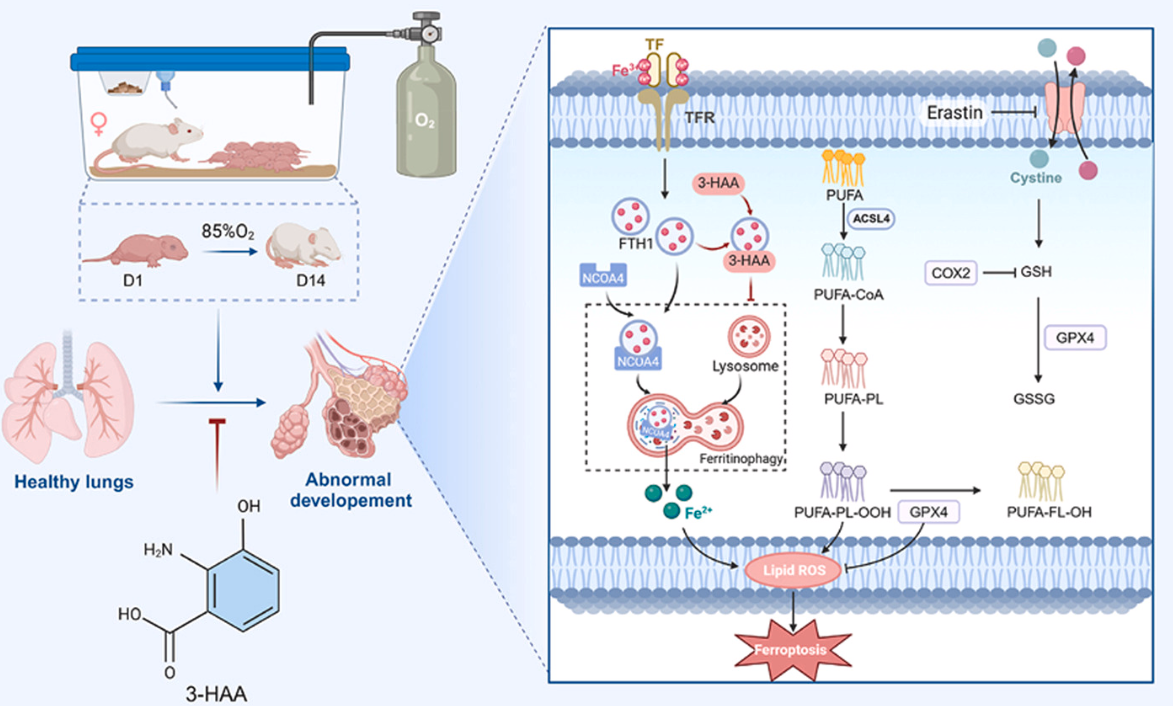
研究结果
1、BPD与3-HAA降低有关
研究者运用UHPLC-MS/MS代谢组学技术(由上海百趣生物提供支持),对BPD婴儿和非BPD婴儿的气管吸出物(Tracheal Aspirates, TAs)中的色氨酸代谢物含量展开分析(图1A)。经鉴定,TAs中存在21种代谢物,其中BPD组的3-HAA和ILA相较于对照组呈现降低趋势(图1B-C)。
鉴于临床样本中这一发现,为进一步探究色氨酸代谢失调是否也存在于实验环境中,研究者构建了成熟的SD大鼠高氧诱导的BPD模型。与对照组相比,BPD组的肺泡明显简化,这表明其肺发育受到了损害(图1D)。在大鼠实验中,鉴定出27种代谢物,且肺组织中的代谢物改变更为显著。其中,BPD组的3-HAA、NAS、5-HTOL较对照组降低(图1E-F)。综上所述,无论是在BPD组的TA样本还是肺组织中,3-HAA均出现减少情况,因此后续围绕3-HAA展开了进一步深入研究。
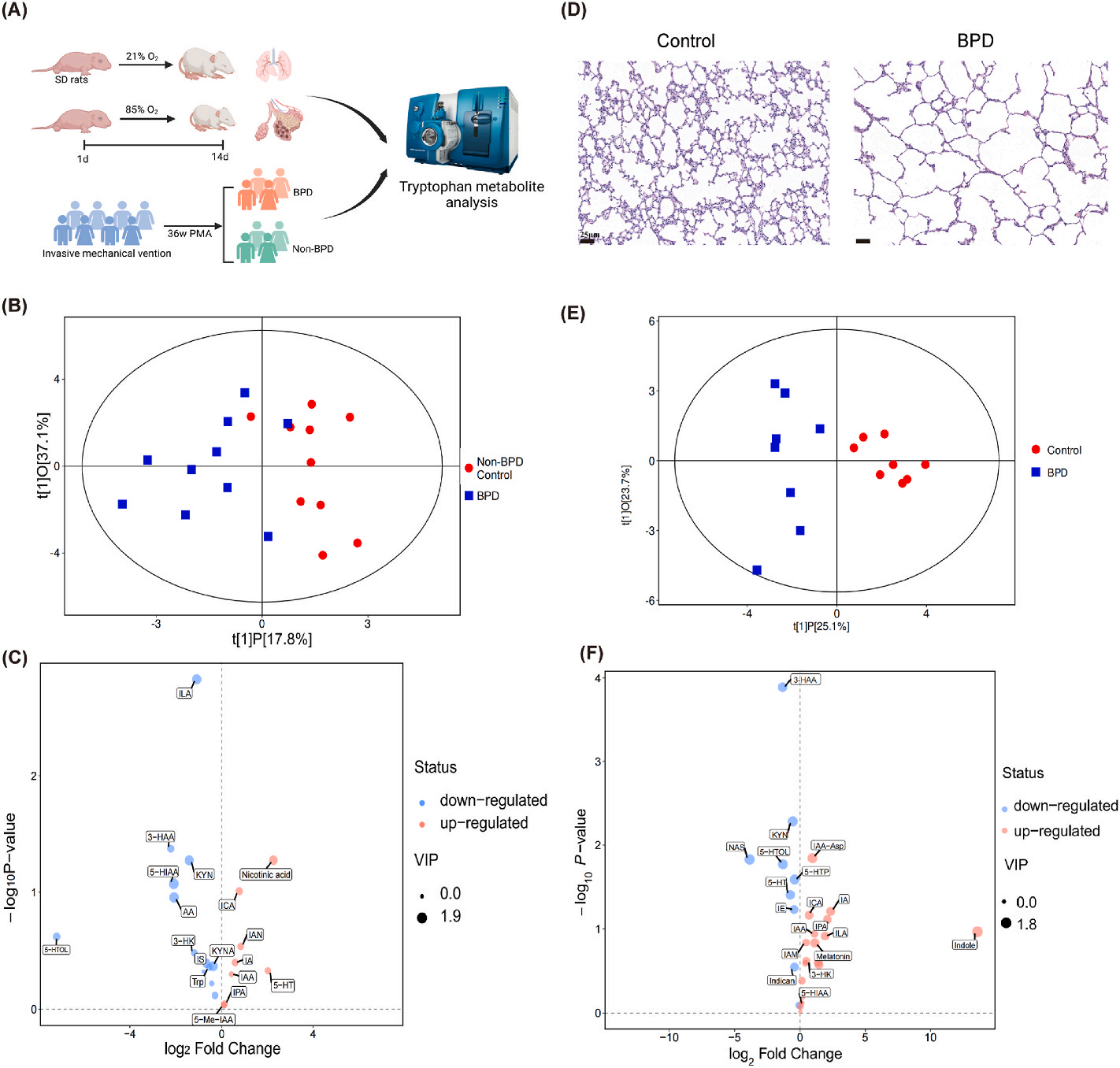
图1.BPD与3-HAA降低有关
2、3-HAA代谢相关酶失调导致3-HAA降低
研究者通过对大鼠肺组织进行3-HAA的IHC染色(图 2A),对肺泡II型上皮细胞(AECII)进行3-HAA的IF染色(图2G),证实了体内和体外高氧模型中3-HAA的减少。为了研究各组间3-HAA水平差异的根本原因,研究者对大鼠肺组织进行了3-HAA代谢相关酶KMO、KYNU和HAAO的WB分析(图2B-C)和IHC染色(图2D-F)。结果表明,BPD组KMO和KYNU蛋白表达降低,导致3-HAA产生减少,而HAAO蛋白表达升高导致3-HAA下游代谢增加。此外,AECII的WB分析(图2H-I)和IF染色(图2J-L)显示了类似的模式:高氧组KYNU和KMO降低,HAAO升高。RT-qPCR结果在体内和体外高氧模型中也是一致的,为体内和体外模型中观察到的差异提供了合理的解释。总的来说,BPD与3-HAA降低有关,这部分是由相关代谢酶的失调引起的。
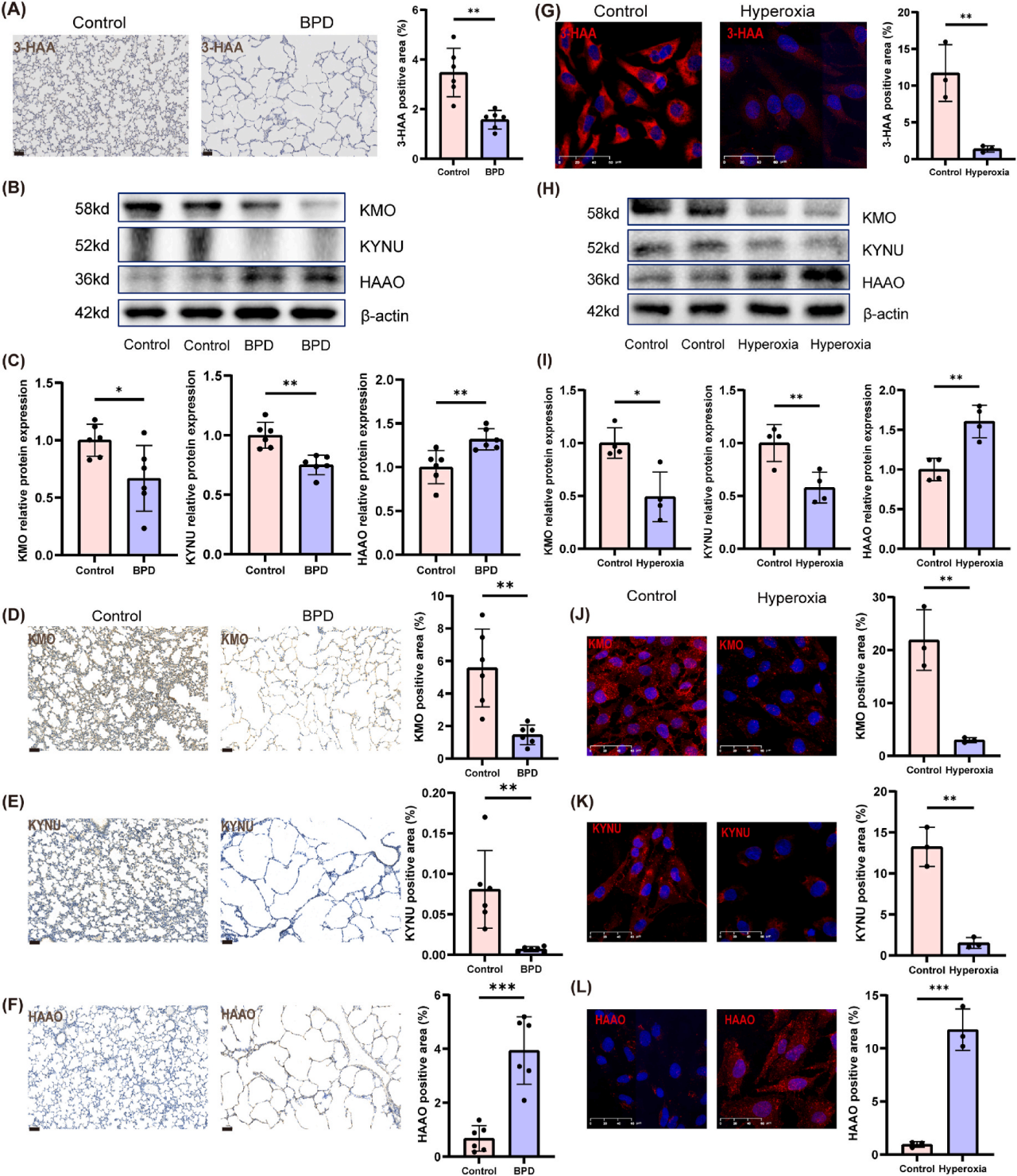
图2.相关代谢酶失调导致3-HAA降低
3、3-HAA可减轻BPD大鼠高氧性肺损伤
研究者深入探究了补充3-HAA能否缓解高氧诱导的BPD,在为期14天的高氧建模期间,BPD+3-HAA组的大鼠按照特定方案,隔天接受3-HAA雾化处理(图3A)。结果显示,3-HAA雾化展现出良好效果,具体表现为显著改善了组织病理学状况,使得 MLI(平均线性截距)数值明显降低(图3B),这反映出肺泡结构得到优化。同时,3-HAA雾化有效地提升了体内3-HAA的水平(图3C),为发挥其保护作用提供了物质基础。尤为关键的是,3-HAA对高氧处理后的SPC细胞起到了明显的保护作用(图3D),有助于维持AECII的正常功能。在蛋白水平层面,3-HAA显著降低了MPO和COX2的表达,有力地减轻了炎症反应,同时增加了SPC的表达,使得AECII损伤得到明显改善(图3E)。总体而言,3-HAA通过改善肺泡复杂性、抑制炎症,对高氧诱导的BPD大鼠模型的肺损伤切实发挥了保护作用。
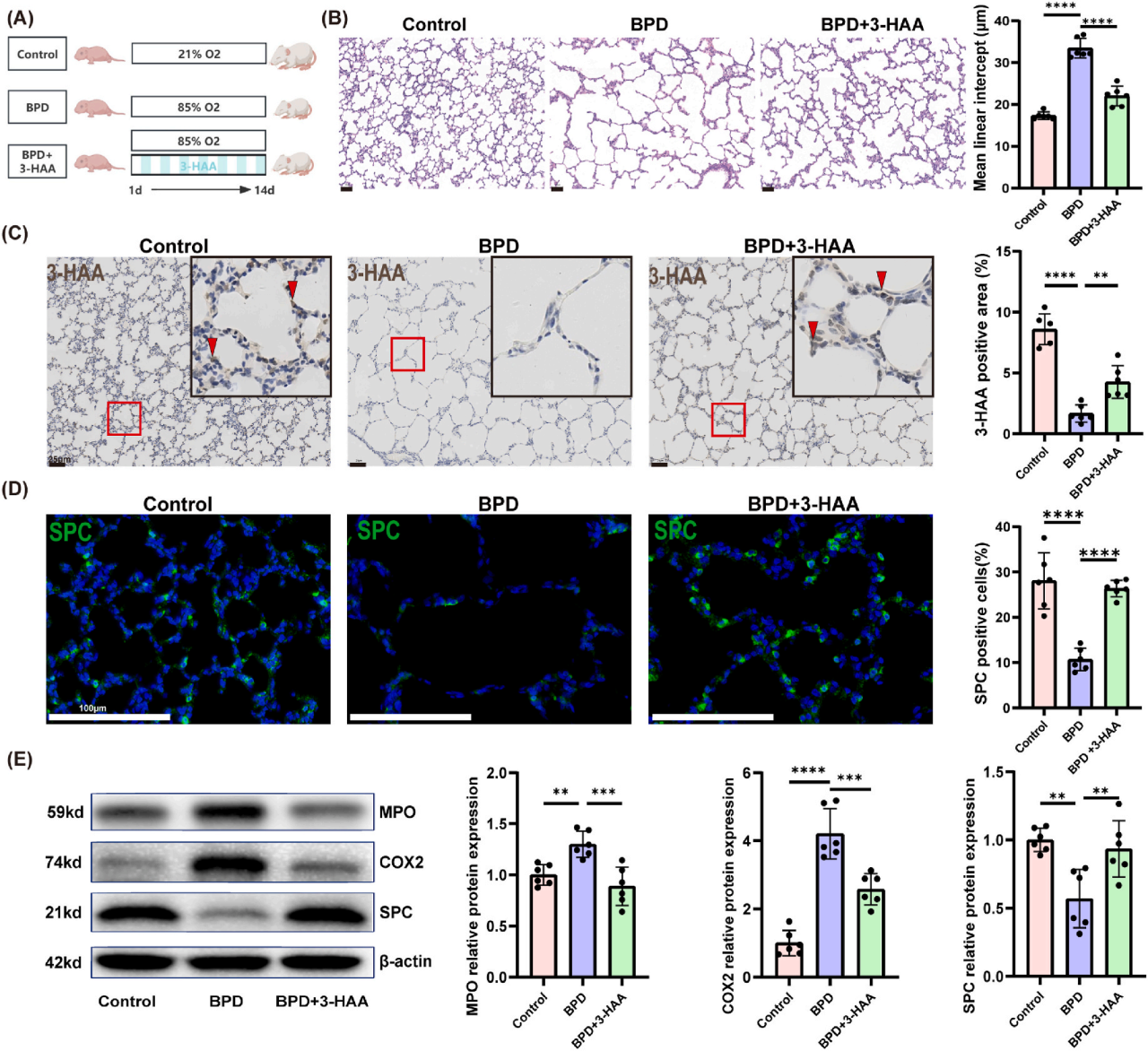
图3.3-HAA可减轻BPD高氧性肺损伤
4、3-HAA可减轻高氧BPD所致肺组织铁死亡
研究者为了探索3-HAA减轻新生大鼠高氧诱导的BPD的潜在机制,通过LiP-SMap方法(MetPro-Ⅱ代谢物与蛋白相互作用,由百趣生物提供)进行了蛋白质组学研究(图4A)。KEGG通路分析和GO分析富集到一种特定形式的细胞死亡,称为铁死亡,这是一种铁依赖的,脂质过氧化驱动的程序性细胞死亡形式(图4B-C)。Fe2+参与芬顿反应,加剧了脂质过氧化和细胞损伤。富含磷脂的线粒体膜特别容易受到氧化损伤,导致线粒体功能障碍和能量代谢受损。接下来,研究者通过评估铁死亡相关蛋白和mRNA表达、醛和Fe2+来评估铁死亡。研究结果显示,高氧诱导的BPD导致肺组织中总醛、亚铁、MDA和4-HNE含量升高,BPD+3-HAA组显著降低(图4D)。此外,经过3-HAA处理后,与BPD组相比,长链酰基辅酶A合成酶4(ACSL4)、转铁蛋白(TF)、铁蛋白重链1 (FTH1)、核受体共激活因子4(NCOA4) 和微管相关蛋白轻链3B-II(LC3B-II)降低,而谷胱甘肽过氧化物酶4(GPX4)升高(图4E)。利用透射电镜观察大鼠肺组织AECII的线粒体改变,揭示了典型的铁死亡相关变化,如线粒体固缩和嵴丢失,3-HAA治疗减弱了这些线粒体异常(图4F)。综上所述,3-HAA可抑制高氧诱导的BPD大鼠模型中的铁死亡,从而减轻肺损伤。
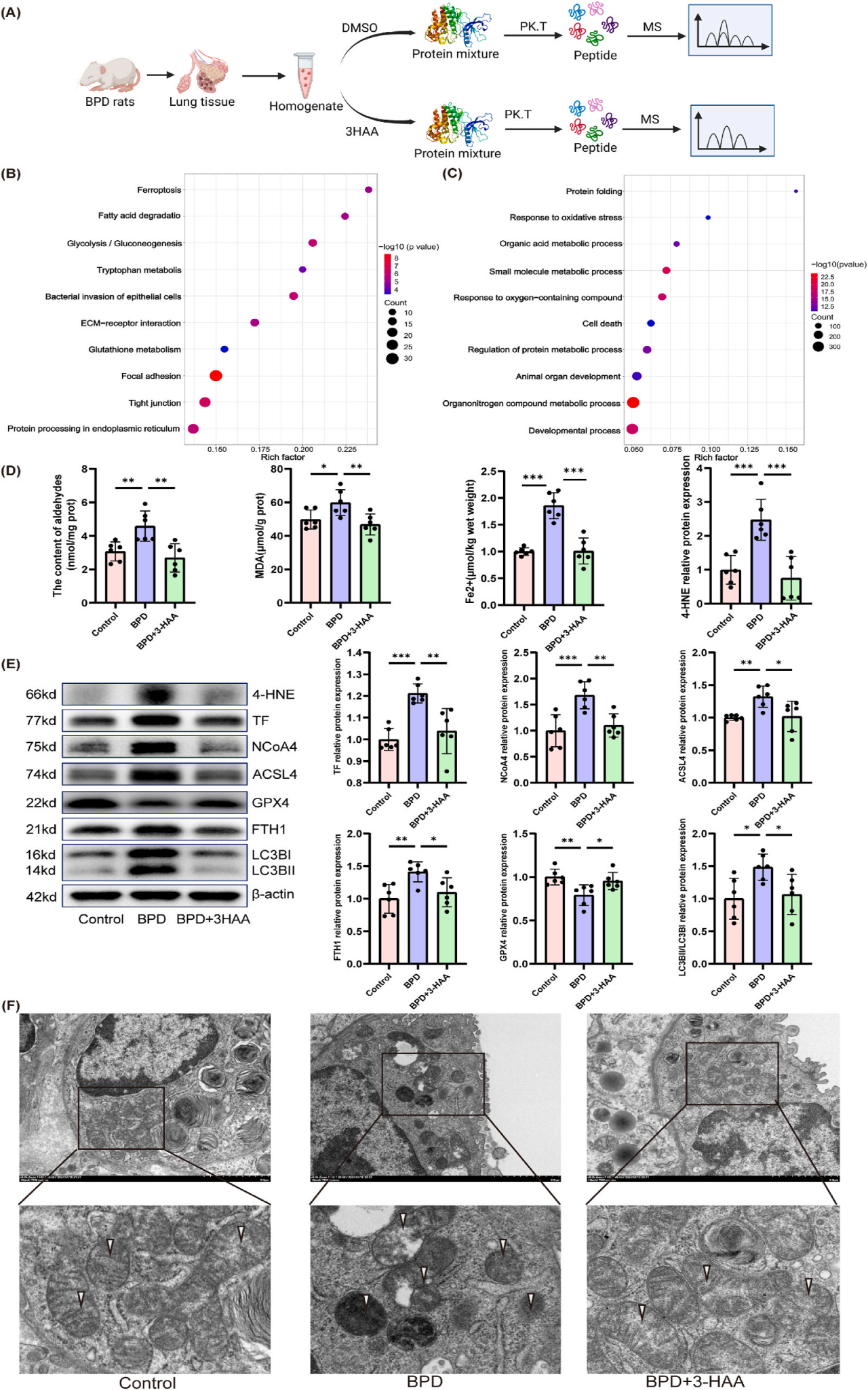
图4.3-HAA通过抑制铁死亡减轻BPD
5、3-HAA抑制了AECII中高氧诱导的铁死亡途径
AECII持续损伤与BPD发生发展密切相关,前期体内实验发现大鼠肺组织AECII存在线粒体铁死亡样变化。研究用CCK-8确定3-HAA、铁死亡诱导剂erastin和抑制剂DFO的最佳浓度,确定最佳浓度后开展体外实验。结果表明,3-HAA和DFO减弱高氧诱导的细胞转化,erastin则逆转3-HAA的作用。在高氧诱导的AECII细胞模型中,用荧光探针DCFH-DA检测的活性氧(ROS)水平(图5A)以及用Liperfluo荧光检测的脂质过氧化程度(图5B),与对照组(C组)相比均显著升高。补充3-HAA和DFO可减少过量的ROS和脂质过氧化产物的生成,而Erastin可逆转这一作用。此外,氧化还原和铁死亡相关指标的含量变化也呈现相似趋势。例如,Fe²⁺、总醛、MDA和H₂O₂,在高氧组(H组)和高氧+3-HAA+Erastin组(HAE组)中升高,经3-HAA和DFO处理后则降低。同样地,谷胱甘肽(GSH)和超氧化物歧化酶(SOD)水平在H组和HAE组中降低,在高氧+3-HAA组(HA组)和高氧+3-HAA+DFO组(HAD组)中升高(图5C-E)。与H组相比,AECII中FTH1、NCOA4、COX2和LC3B-II的蛋白质水平在3-HAA和DFO处理后也降低,而GPX4表达升高(图5F)。然而,3-HAA的抗铁死亡作用被Erastin逆转。由于暴露于高氧环境,AECII细胞出现线粒体收缩和线粒体膜密度增加的现象。3-HAA和DFO处理减轻了线粒体的改变,因为它们在预防铁死亡中起着关键作用。相比之下,Erastin激活了铁死亡,并阻断了3-HAA的保护作用(图5G)。综上所述,这些研究结果表明,3-HAA减轻了高氧诱导的AECII铁死亡。
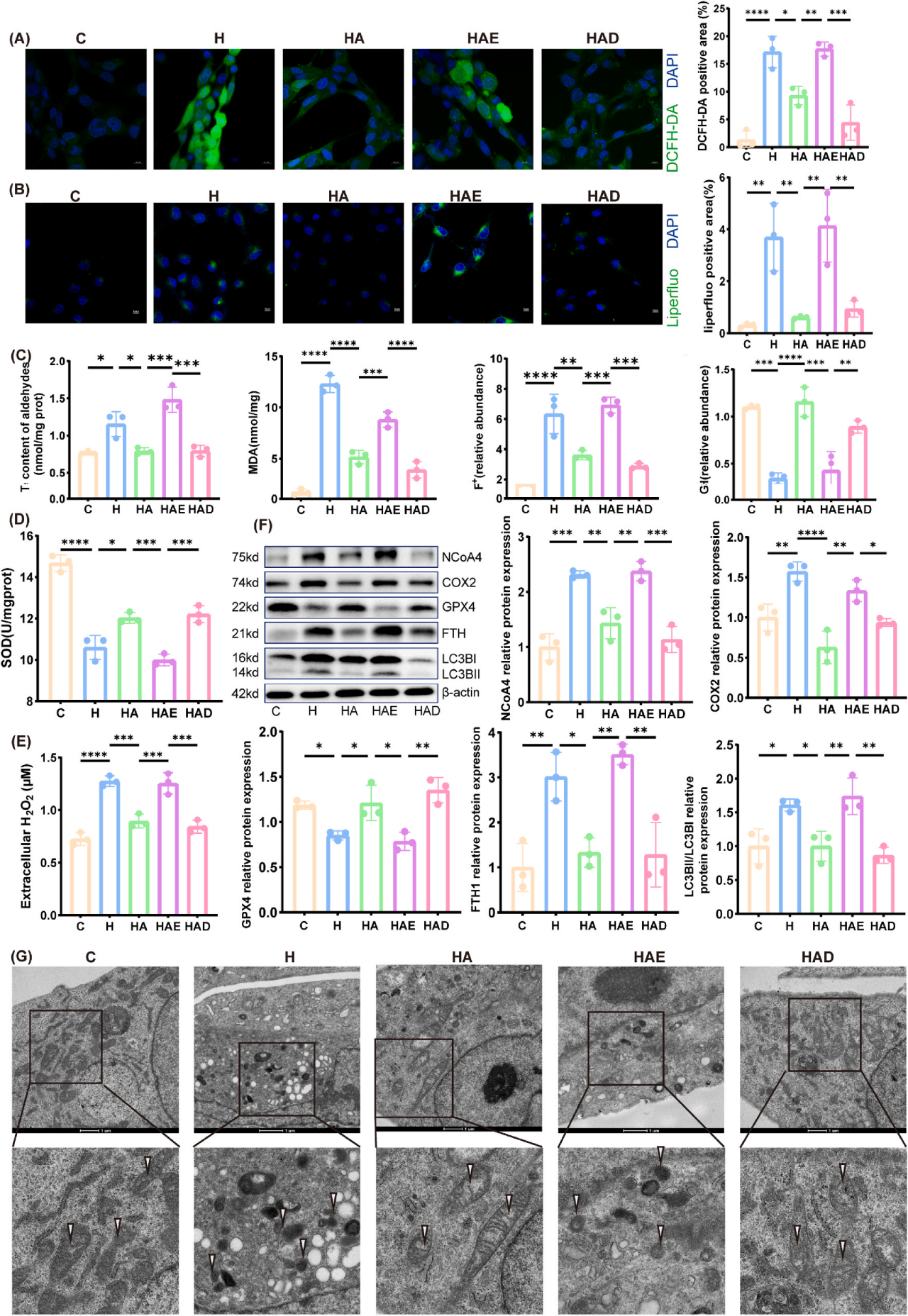
图5. 3-HAA抑制AECII中高氧诱导的铁死亡途径
6、3-HAA通过靶向FTH1抑制铁死亡途径
研究者运用LiP-SMap方法探寻3-HAA的作用机制,发现FTH1极有可能是3-HAA的结合对象(图6A) 。为进一步明确二者关联,采用表面等离子共振技术,深入剖析它们之间的结合动力学与分子亲和力。实验数据清晰显示,3-HAA对FTH1的亲和力呈现出显著的剂量依赖特性(图6B),这表明二者结合紧密。为直观展示FTH1与3-HAA的相互作用方式,研究者借助分子对接技术,精准揭示了二者结合模式(图6C)。结果表明,3-HAA巧妙地通过氢键与 FTH1上的SER31和SER59残基相连。鉴于 NCOA4与FTH1的相互作用在铁蛋白自噬进程中至关重要,研究者再次运用SPR技术,探究3-HAA是否通过干扰NCOA4-FTH1相互作用,来影响铁蛋白自噬。实验结果显示,重组的FTH1能够以高亲和力与重组NCoA4蛋白特异性结合(图6D) 。然而,当体系中引入3-HAA后,FTH1-NCOA4的结合进程被有效阻断(图6E)。为进一步验证该结果,研究者开展了免疫共沉淀实验。结果显示,相较于高氧组AECII,经3-HAA处理后的细胞中,NCOA4与FTH1之间的相互作用明显减弱,在抗NCOA4抗体拉下的免疫沉淀产物中,FTH1的含量显著减少(图6F)。综上,外源性补充3-HAA能够直接靶向FTH1,通过破坏NCOA4-FTH1相互作用,有效缓解铁死亡进程,进而在体内体外实验中,显著抑制高氧诱导的AECII损伤,为BPD的治疗提供了全新的理论依据与潜在靶点。
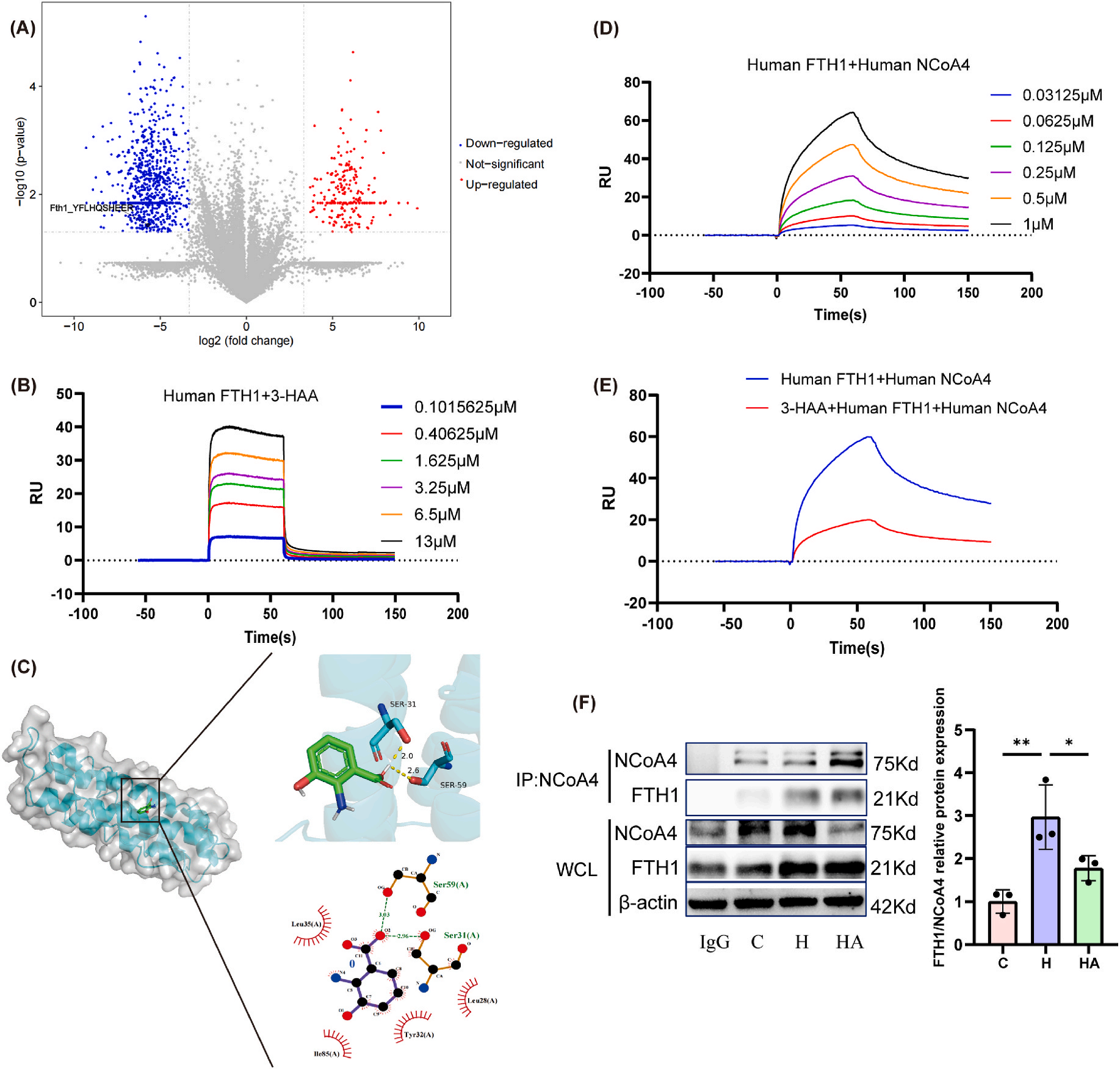
图6. 3-HAA通过靶向FTH1抑制铁死亡途径
研究总结
BPD是需要呼吸支持的早产儿中最常见的慢性肺部疾病。由于缺乏有效的预防和治疗策略,BPD婴儿的死亡率高于非BPD早产儿,预后较差,给家庭和社会带来了沉重的经济负担。了解BPD的潜在发病机制对于制定有针对性的干预措施至关重要。最近的研究强调了代谢功能障碍在高氧引起的肺损伤中的作用。在本研究中,作者旨在探讨色氨酸代谢物在预防高氧诱导的BPD中的潜在作用,并探讨其可能的机制。
本研究首次揭示了BPD与3-HAA水平显著降低相关,表明色氨酸代谢途径失调。补充3-HAA通过靶标FTH1抑制铁死亡途径,从而减轻大鼠和AECII的高氧诱导损伤。本研究强调了靶标3-HAA和铁死亡的临床应用潜力,并为BPD的管理和治疗提供了新的视角。
END
王浩 撰文
Winly 校稿

