间充质干细胞(MSCs)位于骨髓基质内,是一种非造血性多能干细胞,可分化为多种细胞类型,包括成骨细胞或脂肪细胞。骨髓间充质干细胞(BMMSCs)作为一种多能干细胞,因其在再生医学和组织工程中的重要意义而备受关注。随着年龄的增长或骨质疏松,骨髓脂肪生成增加,并与骨量的丧失呈负相关。骨髓脂肪细胞来源于多能的骨髓间充质干细胞,可分化为脂肪或骨。BMMSCs是机械敏感细胞,但机械负荷如何在体内调节骨髓脂肪生成及其对骨重建的影响仍然知之甚少。
2025年10月28日,香港大学徐爱民、王柏乐教授联合法国国家科学研究中心分子与细胞药理学研究所Eric Honoré在国际知名期刊Signal Transduction and Targeted Therapy(IF=52.7)上发表了文章 “Piezo1 activation suppresses bone marrow adipogenesis to prevent osteoporosis by inhibiting a mechanoinflammatory autocrine loop”。研究发现BMMSCs中Piezo1的激活通过阻止CCL2-Lcn2炎症自分泌环路来抑制骨髓脂肪生成以维持骨强度,从而揭示了之前未知的机械转导、炎症和细胞命运决定之间的联系。

· 维真助力 - 慢病毒·
基因信息 KLF2:Kruppel样因子2
病毒产品 Lv-PDGFRα-klf2-eGFP,Lv-PDGFRα-eGFP
体外实验
感染细胞 WT或Piezo1敲除的BMMSCs
MOI 40
感染时间 72h
体内实验
实验动物 雄性PDGFRα-Piezo1 KO小鼠及其同窝WT小鼠
注射方式 两侧胫骨内注射
病毒用量 1.25×106 TU per side
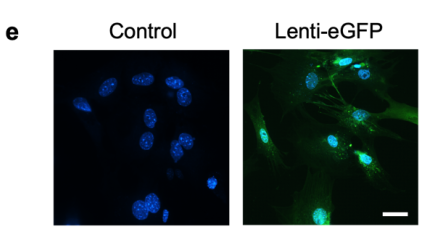
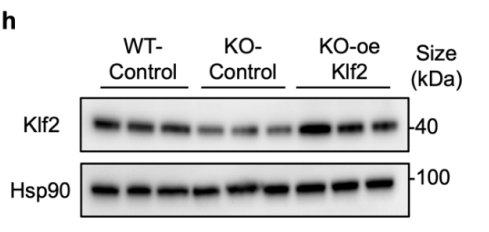
GFP荧光以及WB证实慢病毒介导Klf2在BMMSCs过表达
01 研究结果分享
1、PIEZO1基因缺失的骨髓间充质干细胞优先分化为脂肪细胞而不是成骨细胞
研究人员为探索Piezo1在脂肪组织的发育和功能中的潜在作用,利用血小板衍生生长因子受体α(PDGFRα)-Cre小鼠构建脂肪祖细胞Piezo1基因缺失模型。结果表明PDGFRα+细胞中的Piezo1缺失会削弱成骨作用,增加骨髓脂肪含量,但对周围脂肪组织没有明显影响。接下来,研究人员探索了Piezo1对骨髓间充质干细胞在体外的成骨和成脂能力影响,发现Piezo1 KO BMMSCs的成骨能力比WT BMMSCs低得多,而成脂能力增加,提示Piezo1基因缺失后,骨髓间充质干细胞优先分化为脂肪细胞。考虑到Piezo1在小鼠骨髓间充质干细胞中的重要作用,通过Piezo1激活/抑制进一步研究了Piezo1在人骨髓间充质干细胞(HBMMSCs)中的作用,Yoda1激活Piezo1显著抑制脂肪生成,但促进成骨。相反,通过GsMTx4抑制Piezo1增加了脂肪生成,但抑制了成骨。此外,研究人员通过骨髓移植实验证实了PDGFRα-Piezo1 KO小鼠骨体积减少和骨髓脂肪增加完全是由于骨髓间充质干细胞中Piezo1缺失所致。
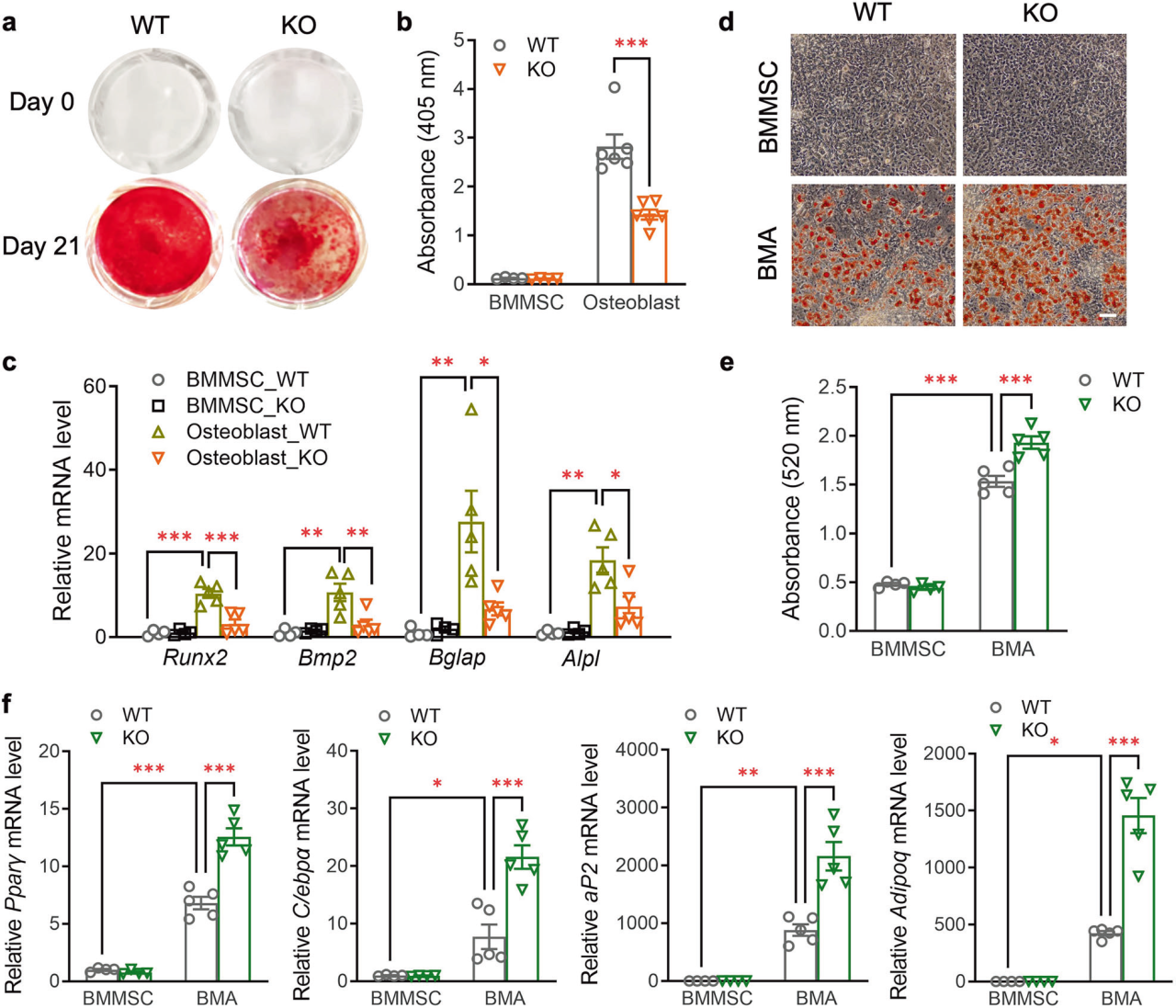
图1.PIEZO1基因缺失的骨髓间充质干细胞优先分化为脂肪细胞而不是成骨细胞
2、PIEZO1缺失增强CCL2-CCR2信号促进Lcn2表达和分泌
大量证据表明,骨髓间充质干细胞来源的自分泌因子在决定骨髓间充质干细胞的谱系定向方面具有重要意义。研究人员进一步探究了Piezo1下游调控BMMSCs成骨或成脂作用的分泌因子,筛选发现了在Piezo1缺失的BMMSCs中显著增加的促炎细胞因子lipocalin-2 (Lcn2)和Ccl2。接下来研究人员探讨了Piezo1缺失是如何上调BMMSCs中Lcn2的表达和分泌。qPCR分析和Olink数据显示,Piezo1 KO BMMSC中Ccl2的表达和分泌水平均大幅升高。Ccl2已被证明通过其自分泌作用在肿瘤细胞中诱导 Lcn2,为了研究 Lcn2 水平是否通过 Ccl2 的 Piezo1 依赖性自分泌作用进行调节,研究人员首先确认了 BMMSC 中 Ccl2 受体 CCR2 的表达,并发现它在 Piezo1 KO BMMSC 中显着上调,此外重组小鼠CCL2蛋白能地将BMMSCs的分化潜能从成骨转变为成脂,并增加了WT BMMSCs中Lcn2的表达和分泌,而CCR2拮抗剂INCB3344可逆转Piezo1 KO BMMSCs 的上述表型,表明CCL2-CCR2信号促进成脂抑骨。进一步研究表明Piezo1 通过抑制 Ccl2 诱发的 NF-κB 激活来抑制 Lcn2 表达和分泌。
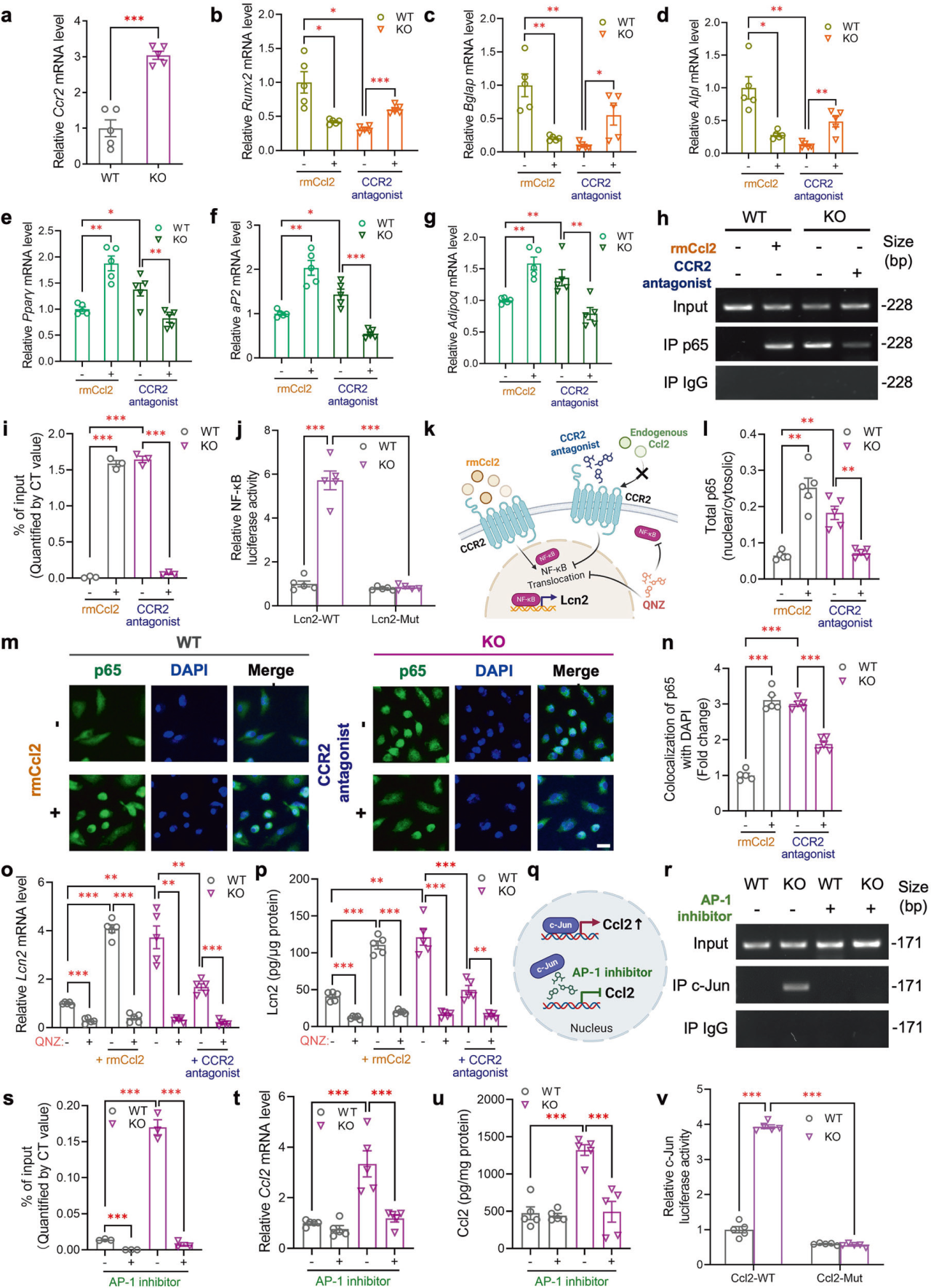
图2. PIEZO1通过抑制CCl2诱导的NF-κB的活化而抑制Lcn2的表达和分泌
3、体内过表达KLF2或下调CCL2/Lcn2逆转PDGFRα-Piezo1 KO小鼠骨量和骨髓肥胖变化
为了验证KLF2-CCL2-Lcn2轴作为Piezo1的下游信号效应器,参与调控骨髓间充质干细胞命运,研究人员利用慢病毒在小鼠体内过表达KLF2或下调CCL2/Lcn2,并在体外BMMSCs已证实该策略的有效性,以及慢病毒胫骨内注射的特异性转导。在PDGFRα+BMMSCs中恢复KLF2的表达逆转了Piezo1 KO小鼠的骨体积减少、骨小梁数量减少、骨密度降低、ALP染色的成骨细胞减少、骨小梁分离增加和BMA增加。同样,在Piezo1缺陷的PDGFRα+BMMSCs中,CCL2或Lcn2被敲低到与WT BMMSCs相当的水平,能减轻Piezo1 KO小鼠的骨丢失和骨髓肥胖症。此外,CCL2基因敲低降低了Lcn2的表达和分泌,而KLF2过表达抑制了KO BMMSCs中CCL2和Lcn2的表达和分泌,进一步支持了KLF2-CCL2-Lcn2信号轴介导Piezo1缺乏引起的小鼠骨丢失和骨髓肥胖的观点。
图3. 体内验证Piezo1-KLF2-CCL2-Lcn2信号轴在调控骨髓间充质干细胞成骨和成脂
02 结论
本研究发现机械传感器Piezo1通过CaMKII/KLF2调节c-jun-CCL2-NF-κB-Lcn2炎症轴,从而平衡骨髓间充质干细胞的脂肪成骨潜能。机械卸载或Piezo1失活会破坏这种平衡,导致BMMSCs中CCL2-Lcn2自分泌环路过度激活,并促进骨髓脂肪生成,进而导致与衰老或肥胖相关的骨骼和/或代谢疾病。运动通过Piezo1开放和下游激活CaMKII/KLF2途径来抑制这种自分泌炎症环路,从而在增加骨密度和减少BMA方面发挥其健康益处。这些数据揭示了机械控制的炎症在决定骨髓间充质干细胞细胞命运中的关键作用,并提出了以Piezo1-c-JunCcl2-NF-κB-Lcn2轴为靶点,作为基于骨髓间充质干细胞治疗衰老和肥胖相关慢性疾病的一种有前途的策略的可能性。
